1. Przy PCl4+ wychodzi mi tetraedr (cztery wiązania i żadnej wolnej pary elektronowej), a przy ICl5 piramida tetragonalna (pięć wiązań i jedna wolna para elektronowa)
3. W tej metodzie dokonujemy kombinacji liniowej orbitali atomowych elektronów walencyjnych atomów wchodzących w skład cząsteczki. Kombinacja czyli dodawanie lub odejmowanie - z dwóch orbitali atomowych otrzymujemy zatem dwa orbitale molekularne nazywane wiążącym i antywiążącym.

"wiążący" dlatego, że ma niższą energię niż dwa orbitale, z których powstał

"antywiążący" dlatego, że ma wyższą energię od orbitali, z których się wywodzi.
Do owej kombinacji liniowej możemy wziąć tylko orbitale spełniające podstawowe kryteria, a są nimi:

taka sama symetria

porównywalna energia

"nakładanie się" orbitali
Orbitali cząsteczkowych wyróżnia się dwa rodzaje:

orbitale
sigma powstałe przez "czołowe" nakładanie się orbitali (takie przy którym mamy tylko jedną "wspólną" przestrzeń) - powstają z dwóch orbitali s, px lub jednego orbitalu s i jednego px.

orbitale
pi powstałe przez nakładanie boczne orbitali atomowych p (takie przy którym mamy dwie wspólne przestrzenie) - powstają one z dwóch orbitali py lub pz
Tworzenie się orbitali molekularnych najłatwiej jest prześledzić na diagramach energii. Przykładowy diagram dla cząsteczki O2:
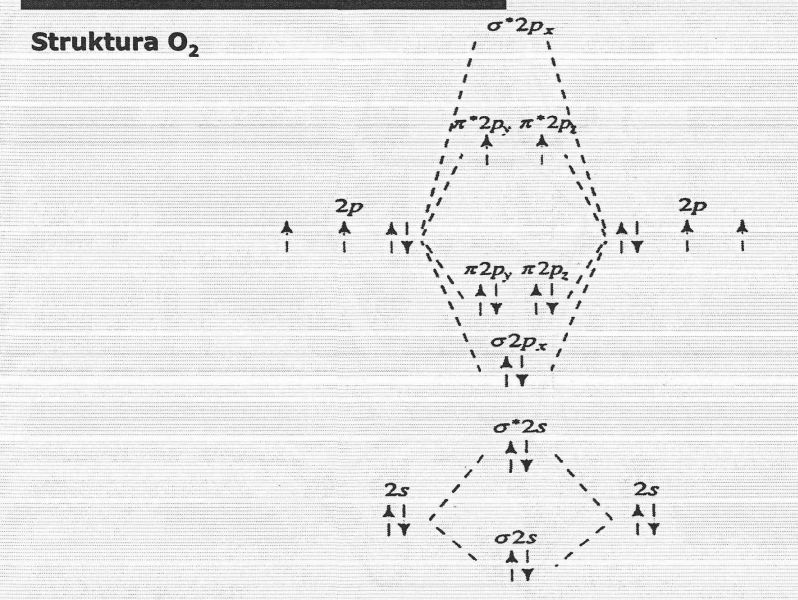
Po prawej i po lewej stronie masz atomy tlenu i fragment ich konfiguracji elektronowej (sama powłoka walencyjna). W środku natomiast masz powstałe orbitale molekularne.
Poniżej masz linki do obrazków, na których widać ładnie nakładanie czołowe (na dwóch pierwszych) i boczne (na ostatnim):
http://www.google.pl/imgres?imgurl=http ... 24&bih=562
http://www.google.pl/imgres?imgurl=http ... 29,r:0,s:0
http://www.google.pl/imgres?imgurl=http ... 29,r:3,s:0