
Re: Orbitale molekularne, rząd wiązania, VSEPR.
Co do zadania 2 - struktury rozrysowane prawidłowo, hybrydyzacje kolejno sp3, sp2, d2sp3; budowa kątowa (kąt mniejszy niż 109* z powodu silniejszego odpychania wolnych par elektronowych, obstawiam ok. 104* jak w wodzie), płaski trójkąt, płaski kwadrat.
1 - diagram dla O2- rozpisany ok, właściwości magnetyczne też dobrze określone, tylko skąd ci tam wyszły 2 niesparowane elektrony? Wyraźnie widać, że jest tylko 1, na antywiążącym. 2 niesparowane ma "zwykła" cząsteczka tlenu. Lewis błędny, powinno być 6 par i 1 niesparowany, jak na diagramie: 3 pary na jednym tlenie, jedna para wiążąca, na drugim tlenie 2 pary i 1 niesparowany. Rw OK.
Bor - wszystko OK. Fajnie tutaj widać różnicę między przewidywaniami MO i teorii Lewisa. Ew. inny możliwy wzór Lewisa to |B-B|
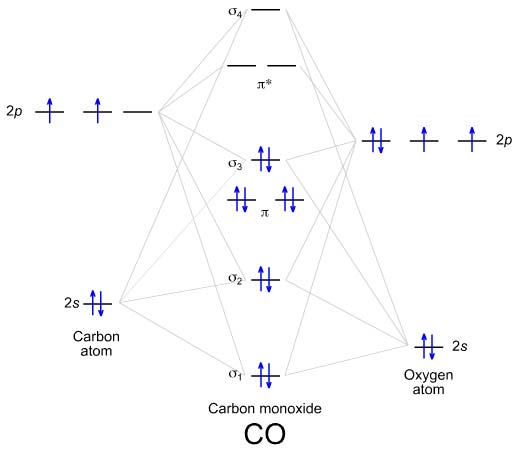
Dla CO+, podobnie jak dla B2, zachodzi zmiana energii orbitali (najpierw 2 orbitale wiążące pi, potem 1 orbital wiążący sigma). Elektronów do zapełnienia diagramu na 2p jest 5 (2 od węgla, 4 od tlenu, minus 1 elektron, bo mamy kation; obojętnie któremu z atomów go zabierzemy

) Wychodzi paramagnetyczne indywiduum z 1 niesparowanym elektronem (na sigma wiążącym) i Rw=2,5. Wygląda to tak jak tu, tylko z jednym elektronem mniej. :
Przydatne linki:
http://www.grandinetti.org/molecular-orbital-theoryhttp://forum.vmc.org.pl/viewtopic.php?t=11578Podsumowując, prawie wszystko zrobiłaś dobrze, więcej wiary w siebie!

