| Autor |
Wiadomość |
|
Kein
******
Dołączył(a): 14 gru 2005, o 19:30
Posty: 693
Lokalizacja: Grudziądz / Gdańsk

|
 Heliantyna - oranż metylowy 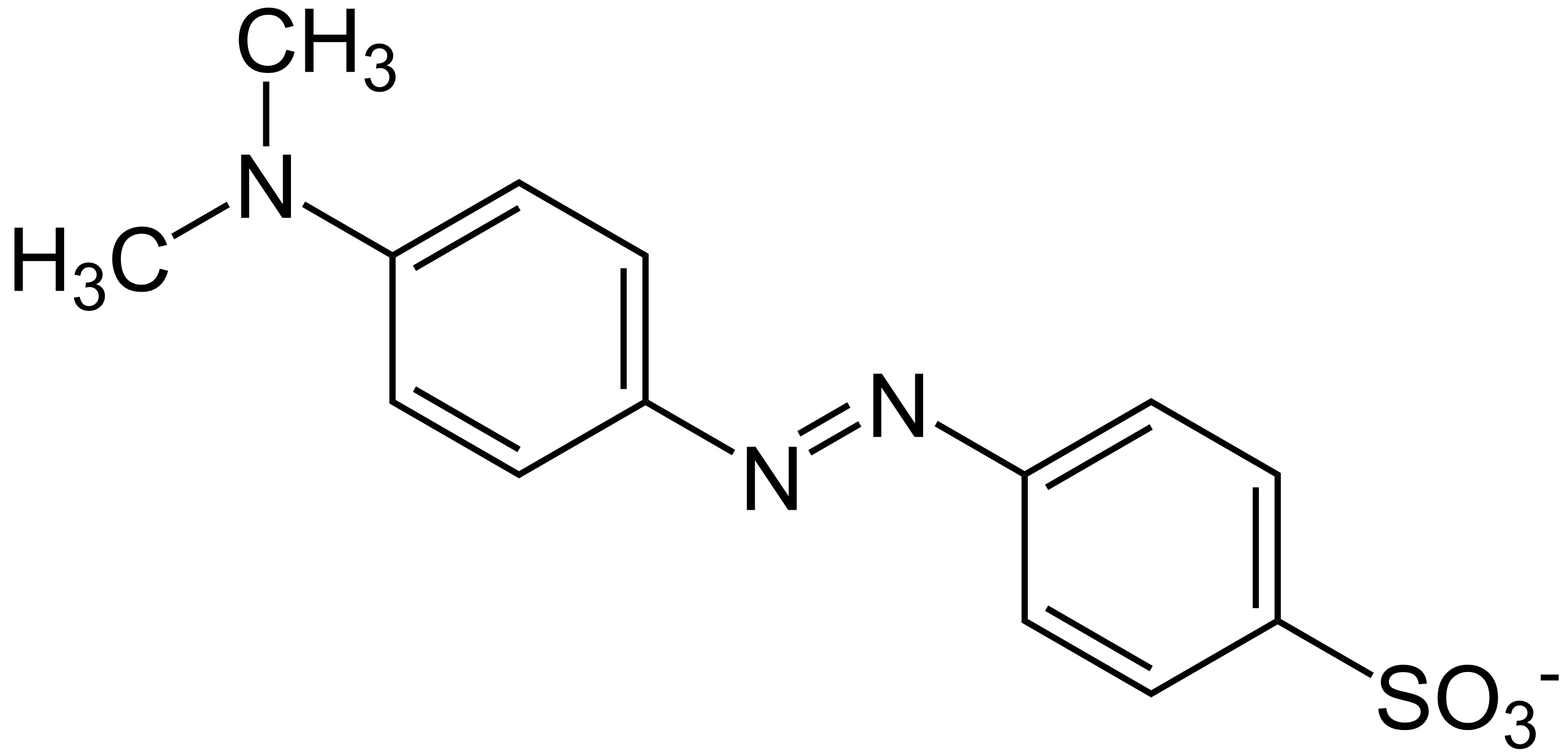
Mam pytanie odnośnie syntezy tego związku z podstawowych substratów takich jak:
-kwas siarkowy(VI)
-Azotan (III) sodu
-Wodortlenek sodu
-Kwas solny
-benzen
-fenylodimetyloamina
-chlor
-amoniak
I w jakiej kolejności miałbym przeprowadzać kolejne reakcje domyślam się że tak.
Najpierw sulfonuje benzen kwasem siarkowym i otrzymuje wodorosiarczan benzylu. Następnie przeprowadzam reakcje wodorosiarczanu benzylu z NaOH aby otrzymać benzylosiarczan sodowy.
Jedną część już mam. teraz wprowadzam do pierścienia jeden atom chloru przu użyciu katalizatora chlorku żelaza (III). Grupa sulfonowa kieruje mi podstawnik w położenie para. następnie zastępuje chlor grupą NH2 działając amoniakiem. mamy już jeden człon naszej układanki. Nastęnie przeprowadzamy diazowanie i sprzężenie tej cząsteczki z cząsteczką fenylodimetyloaminy i mamay oranż metylowy.
Jestem powiedzmy początkujący w dziedzinie chemii organicznej więc proszę wytykajcie mi błędy 
_________________
Dumny student Politechniki Gdańskiej i jej wspaniałego wydziału Chemicznego na kierunku Biotechnologia !
GG:3716505
|
| 18 kwi 2006, o 14:54 |

|
 |
|
Tweenk
@GŁÓWNY MODERATOR
Dołączył(a): 26 mar 2004, o 19:11
Posty: 1171
Lokalizacja: Warszawa

|
Na pewno najpierw nie otrzymujesz wodorosiarczanu benzylu... Chyba chodziło tobie o kwas benzenosulfonowy. Poza tym grupa sulfonowa kieruje w położenie meta, bo wyciąga elektrony. So sulfonowania potrzebujesz oleum - w stężonym kwasie siarkowym idzie dość kiepsko. Reakcja amoniaku z kwasem m-chlorobenzenosulfonowym nie pójdzie - otrzymasz sól amonową tego kwasu. Pod bardzo wysokim ciśnieniem jakiś tam procent może przereagować, ale będzie to w fazie gazowej i się mocno pokisi - generalnie reakcja nie do laboratorium. Aby wprowadzić grupę aminową, najczęściej nitrujemy, a następnie redukujemy grupę nitrową do aminy za pomocą Fe / H+.
Ja myślę że lepiej byłoby wyjść z aniliny, zabezpieczyć bezwodnikiem octowym, sulfonować, potem odbezpieczyć w warunkach zasadowych. Potem diazowanie z NaNO2 w HCl i dodajemy do N,N-dimetyloaniliny (fenylodimetyloaminy). Mamy heliantynę. Nie jestem tylko pewien tego sulfonowania. Ktoś ma inny pomysł?
_________________
Siła to ostateczność, do której uciekają się nieudolni.

Ostatnio edytowano 18 kwi 2006, o 21:38 przez Tweenk, łącznie edytowano 1 raz
|
| 18 kwi 2006, o 21:33 |

|
 |
|
kropla
*****
Dołączył(a): 9 cze 2005, o 16:19
Posty: 304
Lokalizacja: Suchedniów, Poland

|
Acetanilid jest produktem handlowym w podobnej cenie jak anilina, takze szkoda chyba Ac2O na zabezpieczanie:)
|
| 18 kwi 2006, o 21:38 |

|
 |
|
Tweenk
@GŁÓWNY MODERATOR
Dołączył(a): 26 mar 2004, o 19:11
Posty: 1171
Lokalizacja: Warszawa

|
No fakt, trochę szkoda Ac2O.
Widziałem chyba w Boydzie, że da się prowadzić grupę -SO3- do związku przez diazoniowanie - jak to zrobić??
_________________
Siła to ostateczność, do której uciekają się nieudolni.

|
| 18 kwi 2006, o 22:21 |

|
 |
|
sativ
Zasłużony dla forum
Dołączył(a): 1 lut 2005, o 21:11
Posty: 931
Lokalizacja: Poznań

|
Nitrobenzen-->nitrozobenzen-->fenylohydroksyloamina-->anilina-->kwas sufloanilinowy(który dwuazujesz)
sól dwuazoniowa--sprzeganie z dimetyloaniliną-->heliatyna
heliatyne przekształcasz w sól sodowa i masz oranżyk
Mam nadzieje ze nie pomieszałem nic 
Pozdro
|
| 18 kwi 2006, o 22:50 |

|
 |
|
kropla
*****
Dołączył(a): 9 cze 2005, o 16:19
Posty: 304
Lokalizacja: Suchedniów, Poland

|
Tweenk -> to jest odmiana reakcji Sandmeyera - bierzesz wodorosiarczyn miedzi(I) zamiast powiedzmy chlorku miedzi(I).
sativ-> oprocz kwasu sulfanilowego ktory chcemy sprzegac tam nam sie zrobi troche izomeru orto, co nam troche wydajnosc psuje:)
|
| 18 kwi 2006, o 22:57 |

|
 |
|
Arion
***
Dołączył(a): 12 gru 2005, o 22:33
Posty: 608
Lokalizacja: Poznań

|
podczas przemysłowego otrzymywania metylooranzu stosuje się właśnie reakcje diazowanego kwasu sulfanilowego z dimetyloaniliną. Kwas ten, jak kolega Sativ słusznie zauważył otrzymuje się z aniliny poprzez spiekanie jej siarczanu, w wyniku którego następuje przegrupowanie, a surowy kwas oczyszcza się przez przekrystalizowanie z gorącej wody otrzymując dość dobra wydajność. I jestem zdania że kombinowanie z acetanilidem zakrawa na zbędne bawienie sie z chemia niż na podejście mające na celu otrzymanie tego wskaźnika. Po co robić cos trudniej skoro da sie łatwo?
|
| 23 kwi 2006, o 21:07 |

|
 |
|
Kein
******
Dołączył(a): 14 gru 2005, o 19:30
Posty: 693
Lokalizacja: Grudziądz / Gdańsk

|
Dla celów dydaktyczno-doświadczalnych  i jak to określiłeś zabawy z chemią 
_________________
Dumny student Politechniki Gdańskiej i jej wspaniałego wydziału Chemicznego na kierunku Biotechnologia !
GG:3716505
|
| 23 kwi 2006, o 21:29 |

|
 |
|
sativ
Zasłużony dla forum
Dołączył(a): 1 lut 2005, o 21:11
Posty: 931
Lokalizacja: Poznań

|
Jezeli chodzi o barwniki- nie jest potrzebne ich dużo... jak zrobisz 5g oranżu to starczy Ci na następną kadencję rządu....(no, chyba ze będzie to samo co teraz- szopka  )
Dlatego wydajność większego wpływu nie bedzie mieć...
Ale nawet, o ile dobrze pamietam jeśli sulfonowanie prowadzi sie tak około 200* przez pare godzin, to wydajnosć najgorsza nie jest...
A to co napisałem jest prawie banalne nawet przy podstawowym wyposażeniu....
No chyba że ta synteza ma być "dla przyjemności syntezy" 
Pozdro
|
| 23 kwi 2006, o 21:29 |

|
 |
|
Edziorek
Dołączył(a): 11 kwi 2009, o 22:11
Posty: 3

|
mam wielkie pytanie czy ktoś mógłby mnie poratować jakimś materiałem na temat diazoniowania i na temat przekształcenia soli diazoniowych w chlorki?? bardzo proszę o wysłanie materiałów jakichkolwiek na mail: [email protected]
wielkie dzięki za wszelką pomoc[/i]
_________________
Życie to kolorowanka, szkoda tylko że ja mam czarną kredkę...
|
| 6 sty 2010, o 19:35 |

|
 |
|
melon
***
Dołączył(a): 13 lis 2005, o 12:55
Posty: 524
Lokalizacja: z daleka

|
Sprecyzuj o jakie dokładnie materiały Ci chodzi.
Tak najogólniej, to działa się na sól diazoniową CuCl. Aha i reakcja nazywa się diazowanie.
_________________
To nowa era robi ci z mózgu szlam,
Za swoje ruchy ty odpowiadasz sam
|
| 6 sty 2010, o 23:08 |

|
 |
|
Edziorek
Dołączył(a): 11 kwi 2009, o 22:11
Posty: 3

|
chodzi mi o jakiekolwiek materiały z tym związane i jeśli chodzi o precyzję to w wielu książkach pisze diazonowanie a w innych diazoniowanie...
_________________
Życie to kolorowanka, szkoda tylko że ja mam czarną kredkę...
|
| 6 sty 2010, o 23:42 |

|
 |
|
Edziorek
Dołączył(a): 11 kwi 2009, o 22:11
Posty: 3

|
aha bardzo bym była wdzięczna jeśliby te materiały miały mechanizmy  ...z góry dziękuję
_________________
Życie to kolorowanka, szkoda tylko że ja mam czarną kredkę...
|
| 6 sty 2010, o 23:43 |

|
 |
|
Arion
***
Dołączył(a): 12 gru 2005, o 22:33
Posty: 608
Lokalizacja: Poznań

|
Ja mam pytanie dotyczące samego barwnika; czy ma ktoś może widma metylooranżu w zakresie widzialnym w zależności od pH? Może jakieś materiały źródłowe na ten temat? Byłbym bardzo wdzieczny
_________________
Chemik nie upija się, tylko zwiększa labilność konformacyjną.
A poza tym wszystko jest dla ludzi... z głową!
|
| 7 sty 2010, o 01:39 |

|
 |
|
pablo
*
Dołączył(a): 9 sty 2010, o 02:56
Posty: 133
Lokalizacja: Cambridge

|
|
| 9 sty 2010, o 05:46 |

|
 |
|
Arion
***
Dołączył(a): 12 gru 2005, o 22:33
Posty: 608
Lokalizacja: Poznań

|
Wielkie dzięki, chociaż mam mały problem z otwarciem plików. Otóż przy otwieraniu programu, który mi poleciłeś wyświetla sie komunikat:
<center>An Unsupported Action Was Attepted </center>
i wszystko wisi pożerając jednocześnie 92-95% mocy obliczeniowej procka (Sempron 2GHz). Wobec tego, jeśli mogę, to prosiłbym o te dane w postaci np. pdf czy jpg.
Z góry dziękuję
_________________
Chemik nie upija się, tylko zwiększa labilność konformacyjną.
A poza tym wszystko jest dla ludzi... z głową!
|
| 13 sty 2010, o 01:48 |

|
 |
|
maria_awaria
Dołączył(a): 13 lis 2011, o 21:17
Posty: 1
Lokalizacja: gda

|
podbijam
mógłby mnie ktoś poratować mechanizmem reakcji syntezy oranżu?
|
| 13 lis 2011, o 21:32 |

|
|
