
Manganu (II) Wodorotlenek , Mn(OH)2
<center>
WODOROTLENEK MANGANU
Wodorotlenek manganu (II)
Mn(OH)<sub>2</sub>
</center>
-
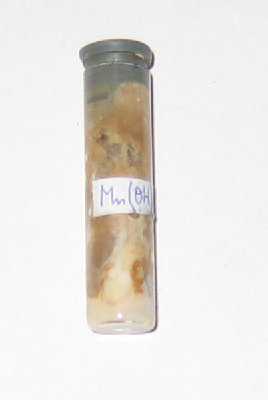
Postać: ciało stałe
-
Kolor: w postaci czystej biały
-
Zapach: bez zapachu
-
Gęstość: brak danych
-
Rozpuszczalność w wodzie: nierozpuszczalny
-
Rozpuszczalność w innych rozpuszczalnikach: brak danych
-
Temperatura topnienia: brak danych
-
Temperatura wrzenia: brak danych
-
Temperatura rozkładu: brak danych
-
Palność: niepalny
Toksyczność: brak danych
-
Higroskopijność: brak danych
-
Przechowywanie: w szczelnych opakowaniach, bez dostępu tlenu - najlepiej w ampułkach
Własne spostrzeżenia: Wodorotlenek manganu można łatwo otrzymać działając wodorotlenkiem sodu lub potasu na jakąkolwiek rozpuszczalną sól manganu, np.
MnCl<sub>2</sub> + 2NaOH = Mn(OH)<sub>2</sub> + 2NaCl
W domowym laboratorium można go otrzymać z baterii

W tym celu rozkrajamy starą baterię i wyjmujemy z niej czarny proszek zawierający m.in. chlorek amonu i tlenek manganu. Proszek ten rozpuszczamy w wodzie i przesączamy. Pozostały osad gotujemy z kwasem siarkowym i przesączamy, następnie do klarownego przesączu dodajemy roztworu NaOH - wydziela się nam biały osad wodorotlenku manganu. Wodorotlenek manganu łatwo utlenia się tlenem zawartym w wodzie do tlenku manganu według równania:
2Mn(OH)<sub>2</sub> + O<sub>2</sub> ---> 2(MnO<sub>2</sub>*H<sub>2</sub>O)
Dlatego gdy wstrząśniemy teraz zlewką z wodorotlenkiem manganu pokryje się on brązowym nalotem uwodnionego tlenku manganu (IV). Reakcję tą wykorzystuje się do oznaczania tlenu rozpuszczonego w wodzie metodą Winklera. Jak widać związek ten jest nietrwały, nie ma sensu, więc go przechowywać - chyba, że ktoś ma manię zbierania bezużytecznych odczynników tak jak ja


Najlepiej jak otrzymany wodorotlenek od razu zobojętnimy kwasem otrzymując sól, np.
Mn(OH)<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> ---> MnSO<sub>4</sub> + 2H<sub>2</sub>O
