| Autor |
Wiadomość |
|
rrozz
**
Dołączył(a): 17 maja 2007, o 20:46
Posty: 104
Lokalizacja: Kraków

|
 Kwas solny- Chemskecz Czy mógłby mi ktoś rozrysować aparaturę do otrzymywania kwas solnego z siarkowego VI i NaCl-u na Chemsketchu. Z góry dzięki.
_________________
Sim&Tech Engineering
Projektowanie Przemysłowe|Doradztwo Techniczne|Symulacje numeryczne
http://simtech.engineering
|
| 12 cze 2008, o 20:42 |

|
 |
|
raymundo
@MODERATOR
Dołączył(a): 18 lut 2007, o 17:00
Posty: 1506
Lokalizacja: SRC

|
to jakieś zaliczenie/podnoszenie oceny pod koniec roku?
a sam se zrób: http://forum.chemik.vitnet.pl/viewtopic ... 320#110320
 |  |  |  | Cytuj: 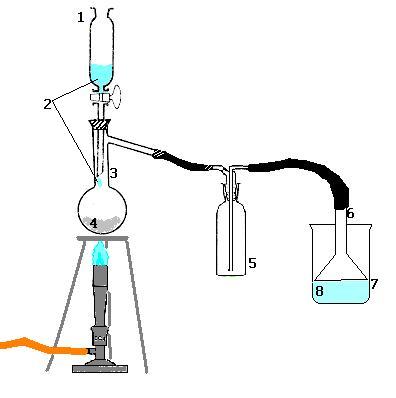 1)wkraplacz 2)stężony kwas siarkowy (VI) 3)kolba destylacyjna 4)sól kuchenna (NaCl, zwykła kuchenna też może być) 5)płuczka (jakby miało zassać kwas) 6)odwrócony lejek (albowiem HCl rozpuszcza się najlepiej w wodzie na jej powierzchni) 7)zlewka  woda des |  |  |  |  |
|
| 12 cze 2008, o 21:34 |

|
 |
|
rrozz
**
Dołączył(a): 17 maja 2007, o 20:46
Posty: 104
Lokalizacja: Kraków

|
Przeprowadziłem syntezę według schematu i jak się okazało jest niesamowicie mało wydajna. bo kiedy lejek jest ponad wodą to kwas się nie rozpuszcza tylko ulatuje, kiedy lejek jest w wodzie to chlorowodór nie chce lecieć przez łączenia i płuczkę tylko "szuka" dziur w obwodzie i ostatecznie ulatuje przez nie albo zwiększa ciśnienie w kolbach. Myślę zatem ze trzeba gaz przepuszczać przez jak największa liczbę płuczek z wodą aby tam się zbierał i rozpuszczał, a ostatecznie wylatywało jak najmniej.
Poprawcie mnie jak źle myślę.
_________________
Sim&Tech Engineering
Projektowanie Przemysłowe|Doradztwo Techniczne|Symulacje numeryczne
http://simtech.engineering
|
| 13 cze 2008, o 22:51 |

|
 |
|
gambit
**
Dołączył(a): 14 sty 2007, o 13:09
Posty: 270

|
Tak się składa, że ta metoda "odwrócony lejek", jest najlepsza, bo HCl najlepiej rozpuszcza się na powierzchni wody..
|
| 13 cze 2008, o 22:54 |

|
 |
|
rrozz
**
Dołączył(a): 17 maja 2007, o 20:46
Posty: 104
Lokalizacja: Kraków

|
Słysze to już któryś raz, a teraz żałuje że nie zważyłem kolby po reakcji to bym ci policzył jaka jest wydajność, a gwarantuje że 80% tego co widziałem na oko to HCl który się ulatniał, woda nawet nie przybrała żółtego zabarwienia.
_________________
Sim&Tech Engineering
Projektowanie Przemysłowe|Doradztwo Techniczne|Symulacje numeryczne
http://simtech.engineering
|
| 13 cze 2008, o 22:58 |

|
 |
|
melon
***
Dołączył(a): 13 lis 2005, o 12:55
Posty: 524
Lokalizacja: z daleka

|
Nie przybrała żółtego koloru bo otrzymałeś czysty kwas solny - żółty to od Fe2+ sie robi.
Ale mi się wydaje, że ze szczelnością aparatury miałeś coś nie tak. A było widać chmurkę HCl nad zlewką 
_________________
To nowa era robi ci z mózgu szlam,
Za swoje ruchy ty odpowiadasz sam
|
| 13 cze 2008, o 23:06 |

|
 |
|
rrozz
**
Dołączył(a): 17 maja 2007, o 20:46
Posty: 104
Lokalizacja: Kraków

|
- Wcześniej jak robiłem to wcale nie z jakiejś soli żelaza tylko z NaCl-u tak jak zawsze bo najtaniej, a kolor miałem żółty tylko robiłem w zawiesinie siarczanu sodu i resztek NaCl-u które wykrystalizowały i pozostał mi czysty kwas
- Możliwe że miałem nie szczelnie ponieważ kolba kulista z odprowadzeniem nie miała szlifu przez co musiałem zatykać korkiem i taśmą termoilozacyjną i odtopić parafiną. Jednak kiedy wyjmowałem lejek ponad wodę to HCl nie ulatywał tymi szparami, a szedł przez wszystkie połączenia tak jak było to planowane, gdy tylko lejek wzadzilem do wody to szukał innego ujścia
- Było widać cholenie duża!

_________________
Sim&Tech Engineering
Projektowanie Przemysłowe|Doradztwo Techniczne|Symulacje numeryczne
http://simtech.engineering
|
| 13 cze 2008, o 23:22 |

|
 |
|
gambit
**
Dołączył(a): 14 sty 2007, o 13:09
Posty: 270

|
Zmiareczkowałeś ten kwas?
|
| 13 cze 2008, o 23:39 |

|
 |
|
rrozz
**
Dołączył(a): 17 maja 2007, o 20:46
Posty: 104
Lokalizacja: Kraków

|
Jeżeli chodzi o stężenie to nie badałem, ale jeżeli chodzi o reaktywność to próbowałem zobojętniać go NaHCO3 i tak mniej więcej po trzech łyżkach czubatych przestał reagować. Wiem, że mało w tym profesionalizmu, ale robiłem tą reakcje jedynie dla próby i sprawdzenia wydajności, jak dojdę do właściwej metody to wezmę się za to poważnie.
_________________
Sim&Tech Engineering
Projektowanie Przemysłowe|Doradztwo Techniczne|Symulacje numeryczne
http://simtech.engineering
|
| 14 cze 2008, o 22:27 |

|
 |
|
Seth
**
Dołączył(a): 21 gru 2006, o 10:07
Posty: 199
Lokalizacja: Teby

|
Jest to pewna metoda otrzymywania HCl. Zanurzając lejek wytworzony gazowy HCl musi pokonać opór wody nad lejkiem częściowo zmniejszony silną rozpuszczalnością HCl w wodzie, ale mimo to w instalacji występuje nadciśnienie i dlatego gaz ulatnia sie poprzez nieszczelności.
|
| 19 cze 2008, o 21:57 |

|
 |
|
Bucefał
Dołączył(a): 28 maja 2008, o 13:43
Posty: 54

|
Skoro jesteśmy w temacie HCl to ja też mam pytanie: Jaka jest procedura wytwarzania kwasu solnego poprzez elektrolizę? Wiem, że z pewnością można w ten sposób otrzymać HCl ale nie wiem jak bardzo stężony (w ilu procentach) będzie taki kwas. Jeśli stężenie rzędu 7% to nie mam sensu:) ale jeśli około 30% to już jest coś myślę.
Nawet w encyklopediach pisze, że HCl otrzymuje się między innymi przez elektrolizę NaCl ale...właśnie... jak krok po kroku to zrobić? wie ktoś?
Bardzo osolona woda, elektrody grafitowe, na anodzie będzie wydzielał się Chlor a na katodzie wodór. Tyle wiem. I następnie trzeba jakoś te dwa gazy zebrać i co dalej? do słoika z wodą wpuścić Wodór i Chlor? czy może jakoś inaczej przebiega ta procedura?
I jeszcze jedno pytanie: Jeśli już udałoby się otrzymać taki kwas solny ale o małym stężeniu, to jak można bardziej go zatężyć?
|
| 21 cze 2008, o 00:23 |

|
 |
|
gambit
**
Dołączył(a): 14 sty 2007, o 13:09
Posty: 270

|
Bucefał lepiej nie kombinuj z otrzymywaniem HCl w ten sposób..
Mieszanie H2 i Cl2 w warunkach domowych nie jest najlepszym pomysłem.. Taka mieszanina lubi wybuchnąć
|
| 21 cze 2008, o 01:12 |

|
 |
|
szalony
***
Dołączył(a): 27 cze 2005, o 20:29
Posty: 1087

|
No nie mogę. Jest taki pokaz. Zmieszanie chloru i wodoru w temperaturze pokojowej na ogół przebiega spokojnie. Gazy wpuszcza się do rurki i zatyka Po oświetleniu promieniami UV lub błyśnięciu impulsem światła np z flesza zachodzi egzotermiczna, gwałtowna synteza chlorowodoru mająca na ogół postać wybuchu z roztrzaskaniem naczynia. Chcesz przeprowadzać takie syntezy ? Zwłaszcza że HCl można kupić nawet w lepszym budowlańcu.
|
| 21 cze 2008, o 01:34 |

|
 |
|
Bucefał
Dołączył(a): 28 maja 2008, o 13:43
Posty: 54

|
 He, no całkowicie się z Wami zgadzam. Oczywiście, że jest to mieszanka wybuchowa. Kiedyś już robiłem podobne rzeczy, na przykład... na słoiku, w którym robiłem elektrolizę NaCl, naciągnąłem torebkę foliową i ją uszczelniłem porządnie. Zaczęła się robić coraz większa, więc Wodór i Chlor jednocześnie napływały do torebki i się tam mieszały. Robiłem to przy świetle dziennym i nic nie wybuchło, dopiero gdy zbliżyłem zapaloną zapałkę, to zrobił się wielki BUUUM 
No nic, rozumiem, że jest to niebezpieczne ale tak jak już kiedyś pisałem gdzieś "mi chodzi tylko o zdobywanie wiedzy" również teoretycznej:) a jeśli już robię coś niezbyt bezpiecznego, to dosłownie stosuję mikro próbóweczki, wszystko jest miniaturowe:) i nawet gdy otrzymam w związku z tym kilka miligramów jakiejś chemicznej substancji, to mam wielką satysfakcję, ze sam ją wykonałem. Więc chodzi mi tylko o maleńkie eksperymenty, które nawet z zastosowaniem niebezpiecznych związków, nie zrobią mi krzywdy, bądź co bądź HCl lub Chlor to nie jest cyjanek potasu 
A więc, czysto teoretycznie zatem jeśli możecie, to powiedzcie jak HCl otrzymuje się? Rozumiem, że Chlor musi być zmieszany z Wodorem (na przykład w baloniku) i co potem? trzeba to jakoś skroplić? czy wypuścić te gazy do słoiczka z wodą?jak to się robi?
|
| 21 cze 2008, o 01:48 |

|
 |
|
raymundo
@MODERATOR
Dołączył(a): 18 lut 2007, o 17:00
Posty: 1506
Lokalizacja: SRC

|
Posh, no spalanie wodoru w chlorze:
prosze, nawet film Ci wrzuciłem:
http://rapidshare.de/files/39782095/rea ... l.avi.html
i baw się dziecko, baw, najlepiej zaciągnij się chlorem tudzież HCl'em.
A no i: TAK- w przemyśle pakują H2 i Cl2 do słoików, odstawiają na 5 dni na półki.
|
| 21 cze 2008, o 09:03 |

|
 |
|
szalony
***
Dołączył(a): 27 cze 2005, o 20:29
Posty: 1087

|
W przemyśle chlor i wodór są wpuszczane na specjalną kolumnę z katalizatorem gdzie zachodzi synteza ciągła w kontrolowanych warunkach p i T 
|
| 21 cze 2008, o 12:59 |

|
 |
|
Bucefał
Dołączył(a): 28 maja 2008, o 13:43
Posty: 54

|
 Jeśli chodzi o otrzymywanie kwasu solnego, to znalazłem w pewnej książce jeszcze jeden prosty sposób: Do próbówki należy wsypać 1/4 łyżki soli kuchennej oraz 1/2 łyżki siarczanu sodu. Następnie ogrzewać nad palnikiem tą próbówkę z zawartością tych składników a rurkę szklaną wychodzącą z tej próbówki połączyć z drugą próbówką, w której zbierać się będą chlor i wodór. Potem wlać do tej próbówki kilka mililitrów H2O i otrzymamy kwas solny, z tym, że będzie to bardzo słaby kwas solny, jak pisze w książce. I teraz mam takie pytanie: Jakie są metody (i czy są proste) zatężania kwasów? Powiedzmy, że otrzymam taki słabiutki kwas solny metodą opisaną wyżej i co potem? jak zateżyć ten kwas aby miał około 30%?
Wiem, że nie jest proste (a raczej niewykonalne w warunkach domowych) uzyskanie kwasu siarkowego, można co najwyżej zrobić sobie kwas siarkawy. Ale w przypadku kwasu solnego, to jest to i tak i tak HCl, więc kwestia tylko jak zatężyć, aby mógł być wykorzystany w doświadczeniach?
Jakaś destylacja? jak w przypadku alkoholu? czy jakieś inne sposoby?
|
| 30 cze 2008, o 22:54 |

|
 |
|
$13rg1ej
@MODERATOR
Dołączył(a): 21 maja 2006, o 12:53
Posty: 497
Lokalizacja: Pułtusk/Warszawa

|
nie bardzo rozumiem skąd wział się wodór ? bo chyba nie z rozkładu wody hydratacyjnej z na2so4:lol:
_________________

Noł fjuczer!
|
| 30 cze 2008, o 23:03 |

|
 |
|
rrozz
**
Dołączył(a): 17 maja 2007, o 20:46
Posty: 104
Lokalizacja: Kraków

|
Najgorsze to jest właśnie to że wszyscy tutaj błyszczą wiedzą tj podbudową teoretyczna. Tylko że ja te sprawy znam na papierze, a w kwestii zrobienia czegoś by hand to pojawia się problem, mam chyba jakąś dysfunkcje. 
_________________
Sim&Tech Engineering
Projektowanie Przemysłowe|Doradztwo Techniczne|Symulacje numeryczne
http://simtech.engineering
|
| 2 lip 2008, o 10:22 |

|
|
